Unter Elektrolyse versteht man einen Prozess, bei dem eine chemische Reaktion – eine sogenannte Redoxreaktion – durch einen elektrischen Strom erzwungen wird. Das bedeutet, dass bei diesem
Prozess elektrische in chemische Energie umgewandelt wird.
Diese chemische Energie kann gespeichert werden und anschließend nach Bedarf wieder zurück in elektrische Energie umgewandelt werden.
Im Fall der Wasserelektrolyse beispielsweise erhält man Wasserstoff, der als chemischer Energieträger gespeichert und durch eine Brennstoffzelle wieder in elektrischen Strom umgewandelt werden
kann.
Grundaufbau eines Elektrolyseurs:
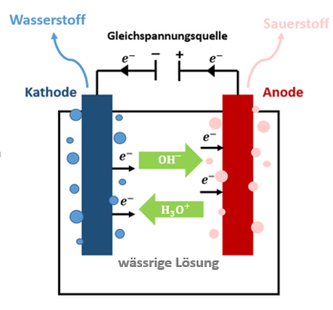
Die Mindestvoraussetzungen für einen funktionierenden Elektrolyseur sind zwei Elektroden - eine Kathode und eine Anode - die mit einer Gleichspannungsquelle verbunden sind und sich in einem
gemeinsamen Elektrolyt befinden, wodurch ein geschlossener Stromkreis entsteht.
Dabei ist die Kathode mit dem Minuspol der Spannungsquelle und die Anode mit dem Pluspol der Spannungsquelle verbunden. An der Kathode herrscht folglich ein Elektronenüberschuss und an der Anode
ein Elektronenmangel.
Geeignete Materialien für die Elektroden sind zum Beispiel Graphit oder Metalle wie Eisen, Platin oder Nickel.
Die Wahl der Elektroden hängt allerdings stark von der gewünschten Reaktion im Elektrolyseur ab. Für die Erzeugung von Wasserstoff und Sauerstoff durch Elektrolyse (Wasserelektrolyse) empfehlen
sich beispielsweise Eisen für die Kathode und Nickel für die Anode.
Bei dem Elektrolyt, in dem sich die Elektroden befinden, handelt es sich um eine Flüssigkeit oder einen Feststoff, der durch Ionen elektrisch leitfähig ist und während der Elektrolyse zersetzt
wird. Dafür werden in der Regel wässrige Lösungen wie Säuren, Basen oder Salzlösungen verwendet. Voraussetzung ist aber immer das Vorhandensein von Ionen. Für die Wasserelektrolyse im Speziellen
eignen sich zum Beispiel verdünnte Schwefelsäure oder eine verdünnte Kaliumhydroxidlösung als Elektrolyt.
Oftmals werden Kathode und Anode auch räumlich getrennt, um unerwünschte Reaktionen im Elektrolyt zu verhindern. Eine Möglichkeit für diese räumliche Trennung ist das Einfügen einer porösen
Membran zwischen den beiden Elektroden, wodurch die für die Elektrolyse essentiellen Ionen ungehindert diffundieren können.
Eine Alternative bietet eine sogenannte Salzbrücke. In diesem Fall befinden sich die Elektroden in verschiedenen Gefäßen. Die Ionenleitung wird hierbei durch die Salzbrücke, die die beiden Gefäße
verbindet, ermöglicht. Eine solche Salzbrücke besteht beispielsweise aus einem feuchten Filterpapierstreifen oder einem U-Rohr, welches mit dem Elektrolyt gefüllt ist.

Prinzip der Elektrolyse:
Durch den Elektronenüberschuss an der Kathode und den Elektronenmangel an der Anode wandern die positiv geladenen Ionen im Elektrolyt – die sogenannten Kationen – zur Kathode, um dort Elektronen
aufzunehmen, und die negativ geladenen Ionen – die sogenannten Anionen – zur Anode, um Elektronen abzugeben.
Den Vorgang der Elektronenaufnahme an der Kathode nennt man Reduktion. Den Vorgang der Elektronenabgabe, die an der Anode stattfindet, nennt man Oxidation. Die beiden Teilreaktionen
Reduktion und Oxidation bilden gemeinsam die Gesamtreaktion der Elektrolyse. Diese Gesamtreaktion bezeichnet man als Redoxreaktion.

Wasserelektrolyse:
Die Wasserelektrolyse beschreibt die Art der Elektrolyse, bei der Wasser in elementaren Wasserstoff und Sauerstoff zerlegt wird. Dabei setzt sich der Gesamtprozess aus vier Teilreaktionen zusammen:
1. Die Oxidation des Wassers: 6H2O -> O2 + 4H3O+ + 4e-
Diese Teilreaktion findet an der Anode statt. Dabei spaltet sich Wasser (H2O) in Sauerstoff (O2), positiv geladene Oxonium-Ionen (H3O+ ) und Elektronen (e-).
Die Elektronen werden direkt an die Anode abgegeben, um den dort herrschenden Elektronenmangel auszugleichen. Der Sauerstoff steigt gasförmig auf und die Oxonium-Ionen wandern zur negativen Kathode.
2. Die Reduktion der Oxonium-Ionen: 3H3O+ + 4e- -> 2H2 + 4H2O
Bei dieser Reaktion werden die von der Anode stammenden Oxonium-Ionen (H3O+) unter der Aufnahme von Elektronen (e-) an der Kathode in Wasserstoff (H2) und Wasser zerlegt. Der entstehende Wasserstoff ist gasförmig und steigt nach oben auf.
3. Die Reduktion des Wassers: 2H2O+ + 4e- -> 2H2 + 4OH-
Bei der der Reduktion des Wassers, die ebenfalls an der Kathode stattfindet, wird Wasser (H2O) unter der Aufnahme von Elektronen (e-) in Wasserstoff (H2) und negativ geladene Hydroxid-Ionen (OH-) aufgespalten. Der Wasserstoff steigt auch hier gasförmig auf und die Hydroxid-Ionen wandern zur positiv geladenen Anode, um den dort herrschenden Elektronenüberschuss auszugleichen.
4. Die Oxidation der Hydroxid-Ionen: 4OH- -> O2 + 2H2O + 4e-
Die negativen Hydroxidionen (OH-) geben Elektronen an die Anode ab und werden in gasförmigen Sauerstoff (O2) und Wasser zerlegt (H2O).
Alle vier Teilreaktionen ergeben gemeinsam die Gesamtredoxreaktion der Wasserelektrolyse:
H2O -> 2H2 + O2
Es werden demzufolge in der Summe zwei Wassermoleküle in zwei Wasserstoffmoleküle und ein Sauerstoffmolekül zerlegt.
Zersetzungsspannung:
Damit es im Elektrolyseur überhaupt zur Elektrolysereaktion kommt, muss an den
Elektroden eine Mindestspannung angelegt werden. Diese Mindestspannung bezeichnet man als Zersetzungsspannung.
Dabei unterscheidet man zwischen der theoretischen und der praktischen Zersetzungsspannung. Die theoretische Zersetzungsspannung beschreibt die theoretisch notwendige Mindestspannung für die
Elektrolyse und ergibt sich aus der Differenz der Elektrodenpotentiale der Prozesse an Anode und Kathode. Die praktische Zersetzungsspannung ist die real benötigte Mindestspannung, die bei
höheren Spannungswerten als die theoretische Zersetzungsspannung liegt. Bei der Wasserelektrolyse beispielsweise liegen die theoretische Zersetzungsspannung bei 1,23 V und die praktische
Zersetzungsspannung bei ungefähr 1,5 V.
Diese Webseite wurde mit Jimdo erstellt! Jetzt kostenlos registrieren auf https://de.jimdo.com
